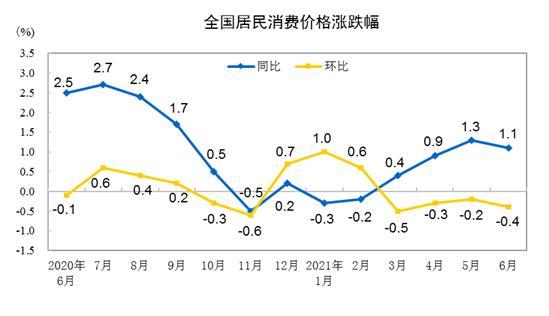
我国将加大境外药品检查 年内或赴美检查HPV疫苗生产企业
近年来进口HPV疫苗相继在中国上市,备受消费者关注。记者今日从原国家食药监局食品药品审核查验中心获悉,我国将对HPV疫苗进行上市后监管,预计年内启动对四价和九价疫苗生产企业美国默沙东公司的药品生产质量管理规范(GMP)检查,以确认企业生产是否持续合规。
食品药品审核查验中心相关负责人介绍,中国GMP标准有300多条,制订时参考了国际欧盟、美国、世界卫生组织的标准,与其GMP基本等效。GMP检查主要针对企业生产现场,包括卫生、质量控制体系、人员、厂房设施设备等是否合规,及其他专业性内容的检查,如偏差管理、工艺等。
据了解,2011年起,核查中心实施境外药品生产检查试点工作。7年来,核查中心境外检查试点工作共完成131个药品境外检查任务,培养国际检查员100余人,检查发现境外药品生产现场违法我国法律、法规、规范共有26个类别、1657条缺陷。
通过境外检查,对部分企业产品采取暂停品种进口、品种不予再注册、在审品种暂停审评审批、限期整改,并经评估后确定是否继续进口等措施。
“境外检查对严控境外药品医疗器械质量有至关重要。通过境外检查,为公众用药安全把住了国门,展示了中国药品监管的能力水平,提高了境外企业对中国药械法律法规的识别与遵循的主动性,使进口我国的境外药械生产更符合中国法律法规的要求。”上述负责人说。
负责人表示,随着对境外进口我国的药品取消口岸检验,境外药械检查将更加至关重要。然而,由于人员数量不足,且受限于团组出国境的次数,与国际检查机构相比,我国的境外检查次数仍远低于发达国家和地区到我国的境外检查次数。下一步,将进一步加强检查员队伍建设,加大境外检查力度。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如有侵权行为,请第一时间联系我们修改或删除,多谢。