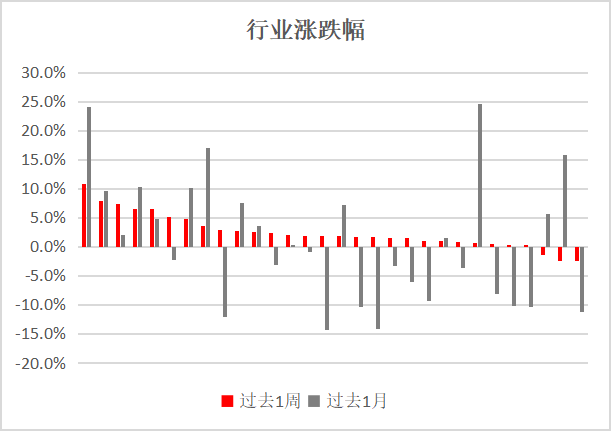
医药行业投资报告:医药政策将继续以“五项制度”为核心
4月5日,CFDA发布《总局关于发布仿制药质量和疗效一致性评价品种分类指导意见的通告》,对仿制药一致性评价品种作出分类。《意见》明确了当前一致性评价品种的各种情形,包括原研进口上市品种、原研地产化品种、进口仿制品种、国内仿制品种、“三改”(改规格、改剂型、改盐基)的仿制品种和国内特有品种6类情形。
文件提出,原研企业在中国境内生产上市的品种可成为参比制剂,既利好跨国企业,又方便国内企业获得参比制剂。国内仿制品种与进口仿制药同等待遇,规则完全相同,原3类新药留有政策余地。国内特有品种从严要求,建议开展证明安全有效性的临床试验,否则CFDA可不建议使用。 如同我们在2017年度策略阐述,一致性评价是除了创新药之外影响未来几年药品行业最深远的政策,实施细则、参考原则等细节文件不断落地,一致性评价稳步推进。更多点评见报告《一致性评价细则陆续落地,国产仿制药格局有望重铸》。
3月28日召开的全国医改工作电视电话会议进一步为深化医改指明了方向。2017年医药政策将继续以“五项制度”为核心(“五项制度”指:合理的分级诊疗制度、有效的现代医院管理制度、高效的全民医疗保障制度、规范有序的药品供应保障制度和严格规范的综合监管制度)。突破点涉及以下十项具体工作:全面启动医联体建设试点;以群众需求为导向,做实家庭医生的签约服务;推进医保支付方式的改革;全面完成城乡居民医保的“六统一”;全面取消公立医院药品加成;认真开展公立医院薪酬制度改革试点;大力推行药品购销“两票制”;全面启动高值医用耗材的集中采购;加强医疗机构绩效考核;加强医药卫生信息化建设。
相关报告:中国医药行业“十三五”发展趋势与投资机会研究报告
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如有侵权行为,请第一时间联系我们修改或删除,多谢。