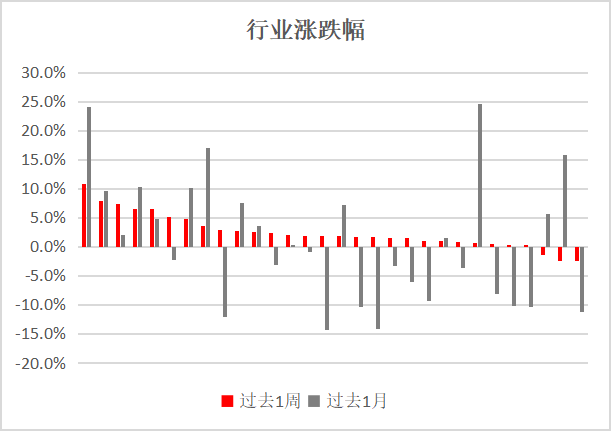
探讨仿制药一致性评价的核心意图及其对药用辅料行业的影响
备受关注的化学药仿制药一致性评价牵动上千家药品生产企业的神经,制剂处方、原料药及辅料杂质、工艺、参比制剂等成为行业内的热门话题,但少有人去探讨仿制药一致性评价的核心意图,并以此为鉴,作出企业的发展战略规划。国家战略层面目标是实现从制造大国向制造强国转换,通过实施“三去一补一降”实现供给侧结构改革,虽然没有明确将医药列为改革的重点行业,但无疑也将涉及医药行业。仿制药一致性评价只是众多医药政策中的一个专项,据了解,国家将在“十三五”期间建立实施全生命周期的管理制度,淘汰长期不生产、临床价值小、疗效不确切、安全风险大、疗效效益不再大于风险、有更好替代品种的药品。预计在“十三五”期间,国家将会进一步制定有关政策,推进医药企业从生产销售型向科技服务型转变。制药行业的改变势必倒逼与其密切相关的药用辅料行业作出调整。
药物研究机构或成药用辅料主要选择者
我国有药用辅料生产企业约300家,生产药用辅料200余种。近年来安徽山河、湖南尔康、河南新开源、安徽黄山等一批企业成为上市公司,红日药业、辽宁奥克、莱美药业、复星医药等上市公司涉足药用辅料。经过十余年的发展,药用辅料行业已经具备一定的规模和实力。重庆斯泰克因其因聚维酮系列产品采用先进的生产技术、规范生产管理、稳定的产品质量,引来辅料行业著名企业德国瑞登梅尔与其合作建立合资企业。
吐温80是在注射液中用量最大的辅料之一。数年前,鱼腥草注射液因临床不良反应报道增多,CFDA全面叫停该品种的生产,经重新审核后只能恢复肌内注射的小容量鱼腥草注射液,鱼腥草注射液从此淡出市场。后经确认,导致鱼腥草注射液过敏发生的主要物质是吐温80,而非鱼腥草。而市场并无注射用吐温80生产,生产注射液所使用的是普通级吐温80,即只能用于口服和外用。有关部门曾经提出过无注射用辅料的,则需要在使用中进行精制。事实证明,对于大分子混合型辅料是无法精制的,其后出现对普通级吐温80进行脱色处理的现象,但是此举并不能提高安全性,只是改善了外观。南京威尔经过数年研究,证明吐温80与原料、工艺有关,其原料必须使用精制油酸,该公司与多家研究机构合作完成了注射用吐温80的研究与生产转化,保证了注射液使用吐温80的安全性。本案提示了药用辅料与药品休戚相关、荣辱与共的关系,也说明一个辅料可以决定一个药品的生命,决定一个企业的兴衰。
国内药用辅料企业与国外药用辅料企业的差距主要在于,产品质量(主要是指功能性指标)持续稳定有待提高,药用辅料应用的技术服务较少,注射用辅料品种短缺,多陷于价格竞争,集中于中低端客户的争夺。客户要求不高,多以是否具有药用辅料批准文号为优先选择的前提,对药用辅料与药物制剂的相容性、制剂安全性等内在质量概念缺位,缺乏药品安全责任感等少有为制药企业与药用辅料供应商关注。
通过以药用辅料、问题等关键词检索,得到相关研究文章1177篇,这些文章少有谈到药用辅料质量与应用研究、药用辅料质量概念,多数只是论及应该如何加强行政审批与监管作为保证药用辅料质量的主要手段。《药品管理法》规定,生产药品所需的辅料,必须符合药用要求。显然,对于同一种药用辅料,因应用的具体药物品种、剂型的不同而可能不同,这种不同可能涉及安全性、药用辅料的功能性指标等。仿制药一致性评价对药用辅料的选择权利与责任将交由药品生产企业决定。在较短的时间内,绝大多数仿制药生产企业不会快速的具备相应能力,而将相应的研究工作委托于药物研究机构,药物研究机构可能成为仿制药一致性所涉及品种所需药用辅料的主要选择者。
药用辅料生产企业客户大幅缩水
可以推测,只有小部分仿制药企业的品种能够通过一致性评价,药用辅料生产企业现有大部分客户的原有需求将消亡。仿制药一致性评价时间紧、要求高、投入大,对于多品种的仿制药企业必然会选择主要品种进行研究,对于实力较弱的仿制药企业,面临淘汰。按照CFDA公布的一致性评价289个品种名单,涉及批准文号数量17740个,按照前三名审评优先、市场(招标)优先、价格优先的三优先原则,极端情况下,具有实际市场意义仿制药文号为867个,意味95%现有需要进行仿制药一致性药品的文号将消亡,或者即使在其后获得通过也将失去市场。同时提示,药用辅料生产企业相应药用辅料品种的客户将集中于少数制药企业,如果药用辅料生产企业的药用辅料品种没有被通过一致性评价的品种在研究阶段选择的话,此后被选择的可能性较小。随着客户消失,药用辅料生产企业相应品种将会需求量萎缩甚至只能选择停产,也可能导致部分药用辅料市场企业退出医药市场。
仿制药一致性评价对药用辅料行业而言,最大的意义在于药用辅料企业推进药用辅料企业从单一的产品生产销售模式,转化到技术优先、质量优先、服务优先的模式。