默沙东K药这项试验遇冷 中国多家药企已布局?
来源:中新经纬 作者:王玉玲
近日,默沙东宣布其PD-1抑制剂Keytruda(帕博利珠单抗,常称K药)联用Lenvima(仑伐替尼/乐伐替尼)的一项III期临床试验失败。
该临床试验属于联合用药,被称为“可乐组合”。中新经纬注意到,中国国内包括君实生物、康方生物等多家药企也开启了类似临床试验。上述临床试验失败对这些药企意味着什么?
试验数据“反转”
根据公开资料,这项临床试验名称为LEAP-002,研究的优效性假设为帕博利珠单抗+乐伐替尼治疗HCC(即肝细胞癌)患者的疗效要优于乐伐替尼单药。
但据结果,与单独接受乐伐替尼治疗相比,接受帕博利珠单抗+乐伐替尼治疗患者的总生存期等临床数据虽有改善趋势,但结果不具有统计学显著改善意义。这样的结果,和此前公布的临床试验数据相比呈现“滑铁卢”。
2019年,在美国癌症年会(AACR)上,默沙东曾公布了Ⅰb期临床试验结果,“可乐组合”用于治疗一线治疗晚期不可切除肝细胞癌(uHCC)患者的客观缓解率为42.3%,无进展生存期达9.7个月。此后,默沙东对临床数据进行更新,患者中位总生存期达到22个月,远高于乐伐替尼单药。根据名为REFLECT的临床试验,乐伐替尼单药客观缓解率为24%,中位总生存期为13.6个月。
因为突出的数据,“可乐组合”用于一线治疗晚期不可切除肝细胞癌患者在2019年7月被美国食品药品监督管理局(FDA)给予突破性疗法认证。
在本次公开III期临床数据后,默克研究实验室全球临床开发副总裁Gregory Lubiniecki博士在公开消息中表示,该联合临床开发项目旨在解决一些最具挑战性的癌症治疗类型(如肝细胞癌)未满足的需求。“根据我们迄今为止看到的大量证据,我们仍然对这种组合的潜力充满信心,并将继续研究其在多种癌症中的作用。”Lubiniecki说道。
为什么是乐伐替尼?
默沙东之所以以“可乐组合”试水肝细胞癌,一方面源于庞大的患者群体,《肝细胞癌免疫治疗中国专家共识(2021版)》写道,原发性肝癌是我国常见的恶性肿瘤,发病率和死亡率分别位列恶性肿瘤第四位和第二位。肝细胞癌(HCC)占原发性肝癌的85%-90%,初诊HCC患者多数为中晚期。
另一方面,目前无论国内外药企都在推动免疫联合用药方案,将PD-1与靶向药物(例如乐伐替尼)、TACE(经肝动脉化疗栓塞术)等局部治疗(恒瑞医药在开展TACE联合卡瑞利珠单抗和阿帕替尼对比单纯TACE用于不可切除的肝细胞癌患者的Ⅲ期临床研究)联用,以期解决单药有效性有限问题。
当前,肝细胞癌的一线联合治疗有两大方案,“T+A”(罗氏的阿替利珠单抗+贝伐珠单抗)和“双达组合”(信达的信迪利单抗+贝伐珠单抗)均已获得国家药监局(NMPA)批准,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗。
“可乐组合”则是将靶向药乐伐替尼与PD-1免疫疗法进行联合。北京肿瘤医院肿瘤科副主任徐刚在回答患者咨询时表示,临床上常将乐伐替尼与PD-1免疫联合治疗,疗效比单用效果好,延长患者生存期。乐伐替尼能够抑制激酶,从而促进抗PD-1的抗肿瘤活性。
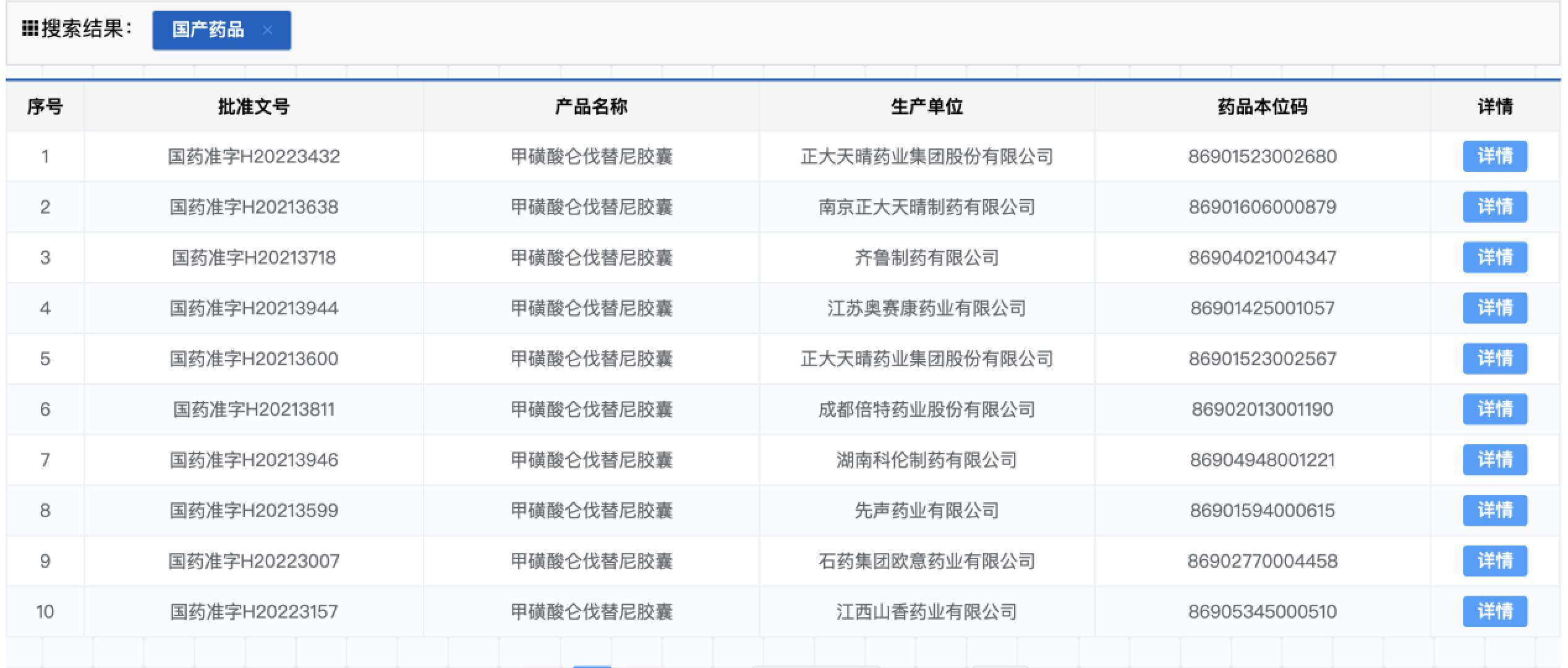
国家药监局截图
同时,相较于贝伐珠单抗的价格,乐伐替尼价格更低。
2018年9月,乐伐替尼在中国获批,彼时定价为1.68万元/盒,每盒30粒,合每粒560元。2020年,乐伐替尼原研药降价80.7%进入医保目录。
此后,根据国家药监局,国内多家药企,包括正大天晴、齐鲁制药、先声药业、石药集团等已获批生产乐伐替尼仿制药。近期,第七批全国药品集中采购在南京开标,7家仿制药企业中标乐伐替尼,平均每粒药报价18元,先声药业报价最低,为96元一盒(30粒4mg),每粒药价格为3.2元。
多家药企开启临床试验
目前,仅针对肝细胞癌适应症而言,多家药企正在进行其PD-1与乐伐替尼的联合试验,或将进一步打开PD-1的新市场。
据国家药监局官网,罗氏在开展阿替利珠单抗联合乐伐替尼或索拉非尼对比单药治疗既往接受“T+A”疗法的肝细胞癌患者的随机、开放性III期研究。
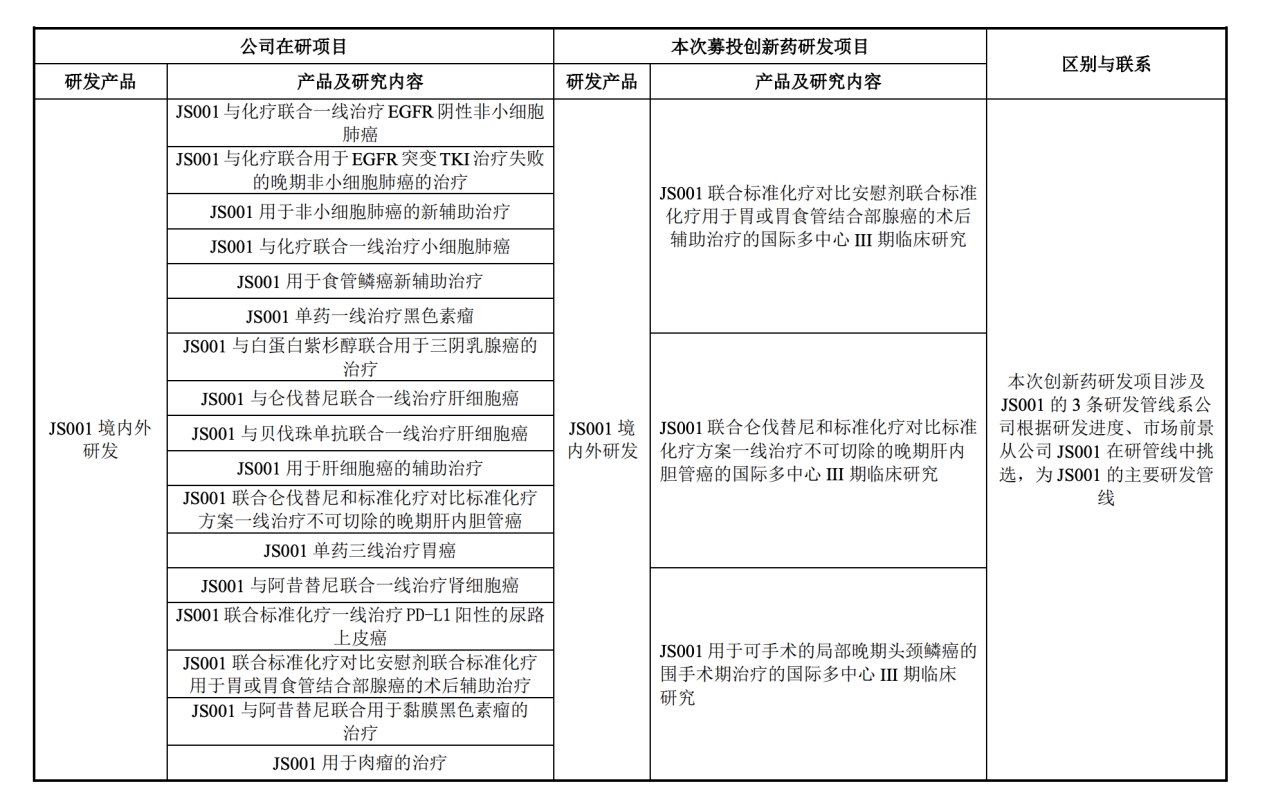
君实生物在开展特瑞普利单抗注射液(JS001)或安慰剂联合乐伐替尼一线治疗晚期肝细胞癌的临床试验。
中新经纬注意到,特瑞普利单抗注射液是君实生物的重要单品,但其在2021年全年销售收入出现下滑。据年报,特瑞普利单抗注射液全年销售收入为4.12亿元,同比下降60%。君实生物表示,国内市场PD-1产品商业化竞争日趋激烈,而特瑞普利单抗仅有小适应症纳入国家医保目录,而适用人群较大的适应症尚未获批上市。
由此,君实生物正积极推动特瑞普利单抗注射液更多适应症获批,6月中旬,君实生物公布了不超过39.69亿的募资定增计划。其中,拟使用募集资金8.6亿元投入到特瑞普利单抗后续境内外临床研发上。
君实生物在后续回复上交所问询函中亦表示,在抗肿瘤产品研发管线布局中,要以大分子药物以特瑞普利单抗为中心,辅以小分子药物,积极探索联合用药。
截图来自君实生物回复函
康方生物在开展卡度尼利单抗注射液(AK104、商品名为开坦尼)单药或联合乐伐替尼治疗晚期肝细胞癌的临床试验。
根据公开资料,卡度尼利注射液于今年6月29日经国家药监局批准,成为首个获批上市的国产双抗,也是全球首款PD-1/CTLA-4双抗,适用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。
康方生物对卡度尼利单抗注射液的商业化寄予厚望,一方面,在积极推动卡度尼利拓宽其他癌症的适应症商业潜力。另一方面,康方生物已建立了超过500名成员的商业团队,并将在2022财年扩展至800人。
基石药业在开展CS1003注射液联合乐伐替尼对比乐伐替尼单药治疗肝细胞癌的III期研究。
总体来看,一方面,默沙东的折戟给了其他药企以警示,哪怕熬过了一、二期临床试验,也可能在三期出现“滑铁卢”;另一方面,PD-1不仅价格“内卷”,适应症也在“内卷”,默沙东“让开了道”后,药企正等待突围。