宣泰医药保健品列入主营被指科创属性不足 回应称保健品为公司提供现金流
中国网财经11月18日讯(记者杜丁 见习记者安荻)日前,科创板上市委2021年第84次审议会议审议结果显示,荣昌生物通过审核,上海宣泰医药科技股份有限公司(“宣泰医药”)“暂缓审议”。
业界人士分析称,宣泰医药被“暂缓审议”,或许跟其业绩下滑、财务数据“前后打架”有关。而宣泰医药在回复中国网财经时则表示,净利润数据不一致是由于公司应审核中心要求对股份支付的会计处理进行了调整。
记者注意到,在发审会上,发审委主要针对宣泰医药通过海外经销商LANNETT销售泊沙康唑中存在的问题进行了较多的提问,主要疑点集中于宣泰医药通过海外经销商LANNET销售公司主营产品泊沙康唑的权益分成收入结算问题。
上会前业绩下滑 招股书财务数据“打架”
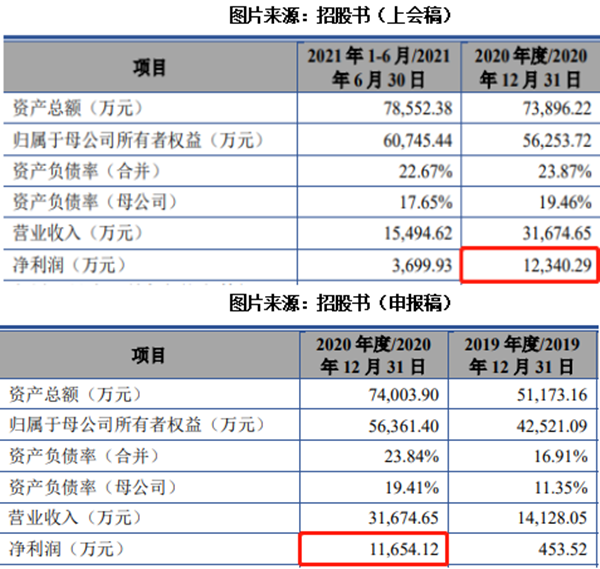
资料显示,宣泰医药系由联合投资、新泰新技术及Finer共同出资组建,经历5次股权转让、2次增资后,于2020年8月28日依法整体变更设立的股份有限公司。2021年5月20日,宣泰医药向上交所提交招股书(申报稿),拟发行4534万股,计划募集资金6亿元。在经历两轮问询后,于11月4日提交招股书(上会稿)。
不过,记者注意到,在公司前后提交的两个版本招股书中存在“数据打架”的情况。在最初披露的申报稿招股书中,2020年净利润为11654.12万元,而最新披露的上会稿净利润为12340.29万元,比申报稿净利润多出686.17万元。
此外,公司上会稿招股书“主营业务收入在境内各省、境外各国家或地区的构成”处称,2018-2021年上半年,其境外收入分别为1956.21万元、7818.76万元、26972.64万元及12006.22万元;境内收入分别为3962.75万元、6238.80万元、4385.82万元及3452.71万元。
而在“报告期内不同区域的销售情况”处显示,境外收入分别为1956.21万元、7761.90万元、26990.46万元及12006.22万元;境内收入分别为3962.75万元、6295.65万元、4368.00万元及3452.71万元。
在应收账款方面,据招股书“期末关联方应收应付款项余额汇总”处显示,2018年末其对上海安羡、海正宣泰的应收账款余额分别为214.42万元、329.59万元。但“应收账款客户分析”处称,2018年末其对上海安羡、海正宣泰的应收账款余额分别为225.70万元、346.94万元。
财务数据存差异,难免会令投资者怀疑公司的业绩状况。
据上会稿财务数据显示,2018年-2021年6月30日,公司分别实现收入6092.59万元、14128.05万元、31674.65万元及15494.62万元;归母净利润分别为-3748.12万元、453.52万元、12340.29万元及3699.93万元;扣非净利润分别为-3671.58万元、1603.42万元、9423.26万元及3831.23万元。
相比于前三年的营利大增,2021年上半年实现营业收入15494.62万元,同比仅增加9.03%;实现归母净利润为3699.93万元,同比下降53.20%;扣非净利润为3831.23万元,同比下降30.56%。
对于上半年的业绩出现“增收不增利”的情况,宣泰医药表示,2021年上半年,由于“研发投入增长较多、股权激励、非流动资产处置损益”等原因造成净利波动。
其中,公司CRO服务收入分别为3630.61万元、5867.34万元、3739.91万元及2180.92万元,占主营业务收入的比例分别为61.34%、41.47%、11.93%及14.11%;产品收入分别为2,288.36 万元、8,190.22 万元及 27,618.56万元和 13,278.01 万元,占主营业务的38.66%、58.26%、88.07%及85.89%,呈逐渐增长趋势。
不难看出,曾经贡献第一大收入来源的CRO服务业务,自2019年开始营收金额逐渐下滑,占比更是由2018年的61%降至2019年的49%直至2020年的12%。相反,产品收入则由2018年的2288万元增至2020年2.76亿元,收入占比提至88%。
不过,宣泰医药在回复中国网财经时表示,公司CRO业务收入较为稳定,比例下降的原因是仿制药业务收入大幅上升。“不同于国际CDMO巨头、国内CRO综合性企业,公司目前仅从事制剂CRO服务。”
“国外竞品 国内限抗令” 中美首仿产品陷两难
宣泰医药主要从事仿制药的研发、生产、销售以及CRO服务。
在仿制药领域,公司已经获得盐酸安非他酮缓释片、盐酸普罗帕酮缓释胶囊、泊沙康唑肠溶片、盐酸帕罗西汀肠溶缓释片等4项仿制药的ANDA药品批件。并通过合作开发的方式,参与完成了马昔腾坦片、碳酸司维拉姆片、艾司奥美拉唑肠溶胶囊等3项仿制药的研发,并ANDA获批。
不过,公司产品品种仍相对有限,主导产品为泊沙康唑肠溶片、盐酸安非他酮缓释片及盐酸普罗帕酮缓释胶囊。报告期内,三种产品合计销售收入分别为1956.21万元、7757.49万元、26443.36万元及12364.52万元,占公司营收的比例分别为32.11%、54.91%、83.48%及79.80%,占比较高。
其中,最大贡献者为泊沙康唑肠溶片。2019年-2021年上半年,该产品分别实现营收5345.66万元、25035.93万元及12021.39万元,分别占产品收入的65.27%、90.65%及90.54%,2020年及2021年上半年占比均超9成。
宣泰医药亦在招股书中坦言,公司目前最主要的产品系泊沙康唑肠溶片,占比较高,而单一产品泊沙康唑肠溶片的销售对公司经营业绩存在较大的影响。
据了解,宣泰医药的泊沙康唑肠溶片于2019年8月获得ANDA批件并上市,并于2021年1月获NMPA的药品批件,为中美首仿。根据IMS数据显示,2020年全年,宣泰医药的泊沙康唑肠溶片在美国市场占有率为41.34%,具有较高的市场份额。
值得一提的是,截至报告期末,该产品主要面向美国市场,LANNETT为公司该产品的海外经销商。根据FDA规定,其他竞争对手一旦获批,其泊沙康唑肠溶片产品即可进入市场参与竞争。
纵观仿制药行业特点,有新竞争对手进入时,新进入的企业会一定程度上挤占原有企业的市场份额,迫使原有企业对定价策略进行调整,进而导致原有企业产品的销量或价格发生下降。
2021年2月,AET的泊沙康唑肠溶片获批。根据IMS数据,2020年,宣泰医药市场占有率为41.34%,原研厂商默沙东为58.66%;2021年1-6月,宣泰医药的市场占有率下降2.48%至38.86%,默沙东下降4.85%至53.81%,AET市场占有率为7.33%。
同时,宣泰医药的泊沙康唑肠溶片的销售量及售价亦发生较大波动。根据IMS数据,美国市场中2021年3-6月由LANNETT经销的泊沙康唑肠溶片产品平均销售单价比上年同期下降约32.73%,销售数量比上年同期仅上升约0.24%。由此测算的公司泊沙康唑肠溶片每年总收入预计下降约5,970.99万元,下滑比例为23.85%。
另一方面,国内市场,宣泰医药的泊沙康唑肠溶片于2021年1月在NMPA获批,并于2021年1-6月实现销售。
不过,作为新一代广谱三唑类抗真菌药物,国内市场的“限抗令”着实对其造成不小打击。招股书显示,泊沙康唑肠溶片目前在中国部分地区被列入了“限制使用”或“特殊使用范围,若未来泊沙康唑肠溶片持续被列入“限制使用”或“特殊使用”范围,可能对其推广和应用产生不利影响。
此外,该产品即未进医保目录,亦未被纳入国家集中采购。并且其国内独家经销商——奥赛康的泊沙康唑注射液已在NMPA获批,若宣泰医药未来泊沙康唑注射液获批,那么将与奥赛康成为竞争关系。
“收FDA信件、被辉瑞起诉” 公司科创属性被质疑
记者注意到,不单单是泊沙康唑肠溶片这一款产品陷“营销两难”境地,公司的另外两个主要产品——盐酸安非他酮缓释片和盐酸普罗帕酮缓释胶囊亦存在收入下降的风险。
近三年,安非他酮的平均单价分别为76.80元/瓶、37.73元/瓶和 59.95 元/瓶,2019年和2020年变动分别为-50.87%、58.87%。2019年及2020年,普罗帕酮的平均单价为188.14元/瓶、93.92元/瓶,2020年变动为-47.41%。
宣泰医药表示,在报告期部分年度,安非他酮及普罗帕酮产品单价呈下降趋势,主要由于市场上竞品数量增加。2020年该产品出口收入及权益分成收入共占营业收入的3.99%,若有新仿制药厂商获批进入市场,则该商品的销售收入存在进一步下降的风险。
其中,值得一提的是,于2019年上市的盐酸普罗帕酮缓释胶囊申报ANDA所涉及的生物等效性试验系由CRO公司Panexcell开展的。
2021年9月16日,宣泰医药收到FDA信件:因Panexcell进行其他生物等效性试验工作时涉嫌伪造数据,要求公司对所申报的盐酸普罗帕酮产品种的生物等效性试验部分进行再研究或撤回该产品的上市申请。
同时,FDA已将公司产品的TE代码暂时变更成BX,具有BX评级的药物仍属于批准上市药物,依然可以通过药房或医院凭处方获得,但无法成为自动替代品牌药物的产品。
报告期内,公司盐酸安非他酮缓释片的营收分别为1956.21万元、1649.99万元、924.73万元及252.73万元,分别占产品收入的85.49%、20.15%、3.35%及1.90%;盐酸普罗帕酮缓释胶囊分别为0、761.84万元、482.70万元及90.40万元,分别占产品收入的0、9.30%、1.75%及0.68%。
已上市产品“状况百出、业绩下滑”,不由得使投资者将目光转向公司的研发成果,寄希望于在研产品。
目前,宣泰医药研发方向主要包括仿制药和改良型新药。截至招股书签署日,宣泰医药存在18项正在进行的主要研发项目,包括抗癌药、精神系统用药、内分泌用药、消化系统用药等。
其中,抗风湿类在研项目——枸橼酸托法替布缓释片整体预算金额为2100万元,2021年预算金额为1000万元,参与人员数量10人,研发进度为“中美资料递交”。
记者注意到,该项目当前正涉及与辉瑞公司(Pfizer Inc.)的诉讼案件。
枸橼酸托法替布缓释片的原研厂商——辉瑞公司共存在三项核心专利,分别为化合物专利、晶型专利和制剂专利,对于辉瑞公司的化合物专利、晶型专利,宣泰医药均提交了PIII声明,即在相关专利失效前,申请人不会上市仿制药,辉瑞公司也未对化合物专利和晶型专利进行任何主张。
针对制剂专利(“181专利”),宣泰医药进行了专利挑战,并于2021年8月20日向辉瑞公司发送了告知函,对专利挑战事项进行了告知,并详细说明了发行人申报的枸橼酸托法替布缓释片不会侵犯原研药的制剂专利。
不过,2021年10月,宣泰医药收到辉瑞公司提起诉讼的起诉状。根据该起诉状,公司在美国申报 ANDA 的产品枸橼酸托法替布缓释片的原研药厂商——辉瑞公司,就公司的枸橼酸托法替布缓释片采用《Hatch-Waxman 法案》第Ⅳ段声明进行专利挑战的事宜在美国特拉华州地方法院发起了诉讼,要求判决宣泰医药的枸橼酸托法替布缓释片的 ANDA 申报侵犯了辉瑞公司“181专利”,公司枸橼酸托法替布缓释片的上市时间不得早于“181 专利”到期时间,即2034年3月14日。
对此,宣泰医药表示,在美国市场,由于进行专利挑战会使得原研药的独占期在专利到期前提前结束,因此原研药厂商针对仿制药的专利挑战,一般均会进行例行诉讼以尽量延缓独占期的结束。因此大部分原研药厂商针对专利挑战均采取了诉讼,属于行业惯例。“针对枸橼酸托法替布缓释片产品,在美国市场,已有Zydus、Sun两家企业获得了暂定批准,辉瑞公司在Zydus和Sun申报ANDA时,也对其提交的PIV专利挑战提起了诉讼,但最终辉瑞公司与上述仿制药企业均达成了和解,相关诉讼被撤销。经公司管理层判断,公司胜诉的概率较大,下一阶段,公司将积极开展应诉工作。”
此外,在专利方面,截至招股书签署日,宣泰医药取得境内专利权46项(发明专利15项)、软件著作权8项及境外专利14项,部分专利为受让取得,多为制备方法类及营养组合物应用类。其中,有6项用于仿制药和CRO服务、8项用于保健食品、1项用于仿制药、CRO服务及保健食品业务。
对此,上交所曾向其下发问询函,要求宣泰医药说明将保健食品等其他产品计入主营业务收入的合理性,将与高端仿制药及 CRO 服务无关的专利认定为形成主营业务收入的发明专利是否准确。并要求保荐机构对公司是否符合科创板定位、科创板属性要求进行进一步的核查。
宣泰医药在回复中国网财经时则表示,公司仿制药、CRO服务和保健食品业务,均是基于公司核心制剂技术开展的业务,公司在综合考量研发或业务周期、投入回报以及产品权利归属等因素的基础上,布局以上三块业务,保证业务结构健康合理。
“在公司的发展历程中,由于CRO服务和保健食品业务周期较短,为公司提供现金流,故业务量前期占比较高,后期随着仿制药产品不断获批上市销售,仿制药及技术含量较高的CRO服务的收入占比逐渐提高,贡献了公司的主要营业收入。招股说明书基于公司目前收入占比情况,将公司主营业务定位于仿制药及CRO服务,而将保健食品业务作为其他收入在主营业务收入中列示。”