伟康医疗业绩连降2年分红2亿 去年产品两度不合格被罚
编者按:8月26日,江苏伟康洁婧医疗器械股份有限公司(以下简称“伟康医疗”)将首发上会,保荐机构为东吴证券股份有限公司,保荐代表人为潘哲盛、王茂华。伟康医疗拟于深交所创业板上市,计划公开发行新股数量不超过1,500万股,占发行后总股本的比例不低于25%。公司拟募集资金3.68亿元,分别用于“年产1,150万支超滑抗菌硅胶导尿管新建项目”、“年产4,800万支吸痰管、1,000万个引流袋新建项目”、“医用高分子材料研发中心建设项目”、“医疗器械营销网络项目”。
伟康医疗两度撤回上市申请。2017年9月25日,伟康医疗报送了首次公开发行并在上交所主板上市的申请,后续撤回申请;2019年6月18日伟康医疗报送了首次公开发行并在深交所创业板上市的申请,后续撤回申请。深交所询问公司前后两次申请首次公开发行上市并撤回申请的原因。
本次发行前,刘春良、刘丽洁父女通过直接及间接方式合计控制公司100%的表决权,为公司的实际控制人;本次发行后,刘春良、刘丽洁父女控制的表决权比例降为75%,仍能够直接影响发行人的重大经营决策。
2020、2021年,公司分红金额分别为10,000万元、5,000万元、5,400万元,合计分红金额2.04亿元。2022年公司通过议案拟向股东分配现金股利1,350万元,尚未实施。
2018年至2021年,伟康医疗实现营业收入分别为24,004.52万元、26,192.33万元、25,355.20万元、24,409.74万元,其中主营业务收入分别为23,487.48万元、25,434.23万元、24,685.55万元、24,159.75万元。
报告期内,公司归属于母公司所有者的净利润分别为6,882.42万元、6,904.39万元、5,470.50万元、5,462.60万元,归属于发行人股东扣除非经常性损益后的净利润分别为5,230.23万元、5,801.54万元、4,655.51万元、4,818.98万元。
报告期内,公司经营活动产生的现金流量净额分别为6,577.28万元、7,989.63万元、9,515.64万元、4,195.41万元,销售商品、提供劳务收到的现金分别为24,661.48万元、27,003.30万元、28,818.82万元、25,171.07万元。
2018年至2021年,伟康医疗员工人数分别为756人、700人、720人、666人。
2018年至2021年,伟康医疗研发费用分别为708.37万元、791.42万元、681.19万元、760.52万元。报告期内,公司研发费用率分别为2.95%、3.02%、2.69%、3.12%,同行业可比公司研发费用率均值分别为3.28%、3.92%、4.16%、4.50%。公司2020年、2021年研发费用率在同行业可比公司中最低。
公司境外市场主要以OEM方式生产销售,即根据境外客户的订单情况进行生产,产品贴客户的商标后进行销售。报告期内,公司境外直接出口金额分别为11,174.50万元、13,526.64万元、11,334.38万元和10,631.74万元,占主营业务收入的比重分别为47.58%、53.18%、45.92%和44.01%。
伟康医疗在招股书中披露了报告期内三起违法违规受到处罚的情况。2018年10月26日,江苏省药品监督管理局在其官网发布“国家医疗器械监督抽检结果的通告(第7号)(2018年第90号)江苏省处置情况”,对伟康医疗就上述一次性使用吸痰管的真空控制装置不符合标准规定的行为实施罚款20,000元的处罚,并要求采取修改模具,并进行验证的整改措施。
2021年2月25日,江苏省药品监督管理局向公司下达《行政处罚决定书》(苏药监宿械罚〔2020〕9号),因公司生产不符合经注册产品标准要求的一次性使用换药包(不合格项目是环氧乙烷残留量),给予35,000元罚款的行政处罚。
2021年10月12日,江苏省药品监督管理局对伟康医疗出具《行政处罚决定书》(苏药监宿械罚[2021]7号),因公司于2021年3月5日生产的300支一次性使用鼻胃管的紫外吸光度不符合经注册产品标准要求(货值金额为7,425元),给予公司罚款45,000元的行政处罚。
报告期内,公司销售给部分经销商的产品存在滞销或临近有效期的情形,根据协议约定或经双方协商一致,公司对相关产品进行退换货处理。报告期各期退货金额分别为58.02万元、693.95万元、197.69万元和31.90万元。报告期内,公司因滞销、近效期的退货占以前年度对应发货金额比例总体较高,大多超过5%。
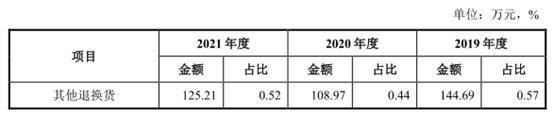
除上述因滞销、近效期的退换货外,报告期内,公司其他退换货的主要情形为产品因物流运输等原因造成外箱受潮或破损等包装问题、少数产品存在质量问题、部分客户下单型号有误等原因形成的退换货,退换货周期较短,大多在发货后一个月内发生。
主营一次性使用医用耗材募资3.68亿元父女100%持股
伟康医疗主营业务为一次性使用医用耗材的研发、生产和销售。经过多年的经营发展,公司产品已涵盖手术护理、呼吸、麻醉、泌尿和穿刺五大系列的上百种规格型号,主要产品为吸引管、吸痰管、鼻氧管、引流袋(包括防逆流引流袋、精密引流袋)等医用高分子材料类产品。
截至招股说明书签署日,昊鹏实业持有公司77.27%股权,为公司的控股股东。公司实际控制人为刘春良、刘丽洁父女。其中:刘春良直接持有公司13.64%的股份,刘春良、刘丽洁通过昊鹏实业间接控制公司77.27%的股份,刘春良通过上海宏建间接控制公司9.09%的股份。
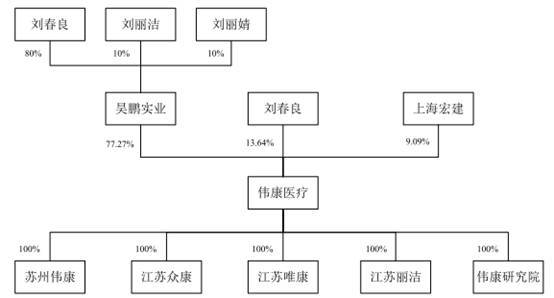
本次发行前,刘春良、刘丽洁父女通过直接及间接方式合计控制公司100%的表决权,为公司的实际控制人;本次发行后,刘春良、刘丽洁父女控制的表决权比例降为75%,仍能够直接影响发行人的重大经营决策。
伟康医疗拟于深交所创业板上市,计划公开发行新股数量不超过1,500万股,占发行后总股本的比例不低于25%。本次发行的保荐机构为东吴证券股份有限公司,保荐代表人为潘哲盛、王茂华。
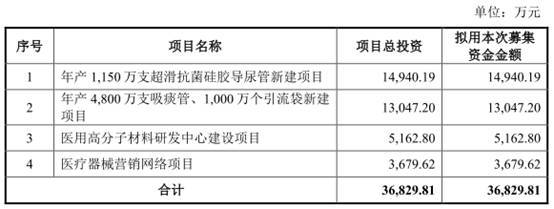
伟康医疗拟募集资金36,829.81万元,其中14,940.19万元用于“年产1,150万支超滑抗菌硅胶导尿管新建项目”、13,047.20万元用于“年产4,800万支吸痰管、1,000万个引流袋新建项目”、5,162.80万元用于“医用高分子材料研发中心建设项目”、3,679.62万元用于“医疗器械营销网络项目”。
两度撤回上市申请遭问询
深交所在问询中指出,2017年9月25日,伟康医疗报送了首次公开发行并在上交所主板上市的申请,后续撤回申请;2019年6月18日伟康医疗报送了首次公开发行并在深交所创业板上市的申请,后续撤回申请。深交所询问公司前后两次申请首次公开发行上市并撤回申请的原因。
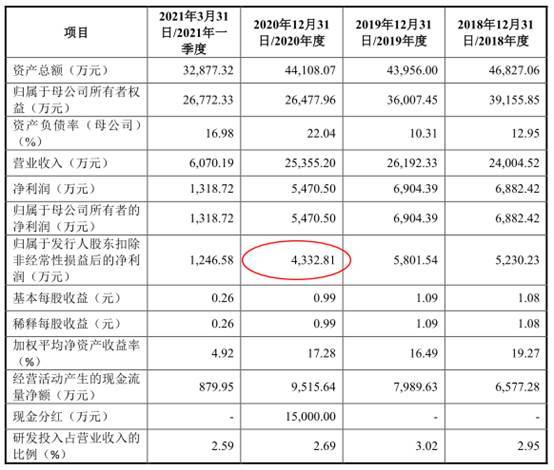
关于第一次申报,公司在问询回复中表示,2017年9月,伟康医疗报送了首次公开发行并在上交所主板上市的申请,于2018年7月撤回申请。公司第一次申报对应报告期内(2014年-2017年)扣除非经常性损益后归属于母公司所有者的净利润分别为1,653.18万元、3,967.02万元、4,692.14万元和5,051.91万元,考虑到自身业绩规模较小,主板审核存在不确定性,公司基于自身发展战略的考虑,撤回申报并计划另行申报创业板。
该次申报系公司主动撤回申请材料,监管机构未向公司下发过规范整改要求,且该次申报撤回已满36个月。因此,该次申报不存在需要整改落实的事项或影响本次发行上市的实质性障碍。
关于第二次申报,公司表示,2019年6月,伟康医疗报送了首次公开发行并在深交所创业板上市的申请,于2019年9月被中国证监会抽中现场检查后撤回申报申请。撤回申报主要由于公司计划进行经营战略调整,进一步聚焦一次性使用医用耗材主业,剥离与主营业务生产无关的苏州地区土地和房产;公司预计审核期限将明显延长,面临外部机构投资者的兑现回报压力;公司前次申报期后部分经销商存在大额退换货事项,涉及对前次申报期内的财务报表进行追溯调整。
两年分红2.04亿元1350万元尚未实施
2020年4月10日,公司2020年第一次临时股东大会审议通过《关于利润分配方案的议案》,以2019年末总股本55,000,000股为基数,按每10股派发现金红利18.18元(含税),合计向股东分配现金股利10,000万元。该利润分配方案于2020年6月实施完毕。
2020年7月20日,公司2019年度股东大会审议通过《2019年度利润分配预案的议案》,以2019年末总股本55,000,000股为基数,按每10股派发现金红利9.09元(含税),合计向股东分配现金股利5,000万元。该利润分配方案于2020年7月实施完毕。
2021年6月18日,公司2020年度股东大会审议通过《2020年度利润分配预案的议案》,以总股本45,000,000股为基数,按每10股派发现金12元(含税),合计向股东分配现金股利5,400万元。该利润分配方案于2021年11月实施完毕。
2022年5月10日,公司第三届董事会第七次会议审议通过《2021年度利润分配预案的议案》,以公司总股本45,000,000股为基数,按每10股派发现金红利3元(含税),合计向股东分配现金股利1,350万元。该利润分配方案已经2021年度股东大会审议通过,尚未实施。
业绩连降两年
2018年至2021年,伟康医疗实现营业收入分别为24,004.52万元、26,192.33万元、25,355.20万元、24,409.74万元,其中主营业务收入分别为23,487.48万元、25,434.23万元、24,685.55万元、24,159.75万元。
报告期内,公司归属于母公司所有者的净利润分别为6,882.42万元、6,904.39万元、5,470.50万元、5,462.60万元,归属于发行人股东扣除非经常性损益后的净利润分别为5,230.23万元、5,801.54万元、4,655.51万元、4,818.98万元。
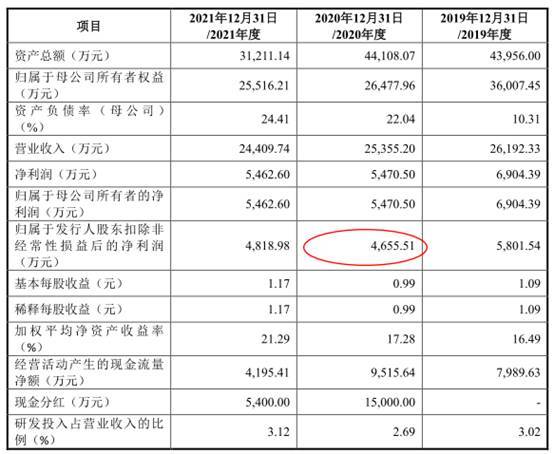
2021年9月30日招股书申报稿显示,2020年归属于发行人股东扣除非经常性损益后的净利润为4,332.81万元。
报告期内,公司经营活动产生的现金流量净额分别为6,577.28万元、7,989.63万元、9,515.64万元、4,195.41万元,销售商品、提供劳务收到的现金分别为24,661.48万元、27,003.30万元、28,818.82万元、25,171.07万元。
公司截至2022年6月30日的相关财务信息未经审计,但已经中汇会计师审阅。根据中汇会计师出具的“中汇会阅[2022]6215号”《审阅报告》,公司2022年1-6月实现营业收入12,285.47万元,较上年同期增长20.03%;扣除非经常性损益后归属于母公司所有者的净利润为3,173.07万元,较上年同期增长48.05%。
员工人数呈下降趋势
2018年至2021年,伟康医疗员工人数分别为756人、700人、720人、666人。

从专业结构来看,截至报告期末,公司生产人员469人,占比70.42%。
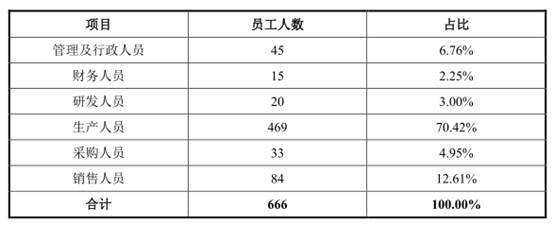
从受教育程度来看,截至报告期末,公司大专以下531人,占比79.73%。

去年研发费用761万元
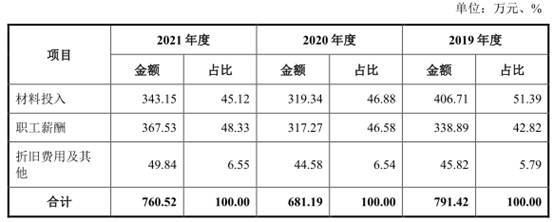
2018年至2021年,伟康医疗研发费用分别为708.37万元、791.42万元、681.19万元、760.52万元。
其中,职工薪酬金额分别为322.53万元、338.89万元、317.27万元、367.53万元,占比分别为45.53%、42.82%、46.58%、48.33%。
报告期内,公司研发费用率分别为2.95%、3.02%、2.69%、3.12%,同行业可比公司研发费用率均值分别为3.28%、3.92%、4.16%、4.50%。
公司2020年、2021年研发费用率在同行业可比公司中最低。
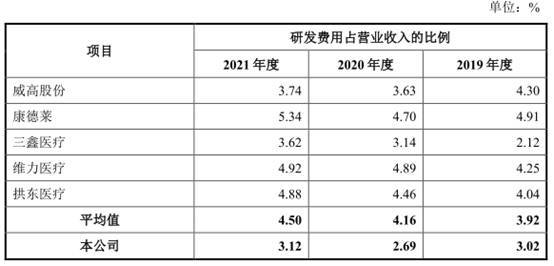
招股书称,报告期内,公司研发费用占营业收入的比例低于同行业可比上市公司平均值,研发投入规模较同行业可比上市公司存在一定差距,主要是由于:(1)报告期内,公司研发项目主要为现有产品改良和产线自动化改造,而康德莱、三鑫医疗、维力医疗等可比上市公司在既有主要产品研发改良的基础上,还对介入类耗材、骨科类耗材等高值医用耗材和血液净化装置等医疗设备产品进行了持续的研发投入,研发方面更为广泛;(2)公司参与研发人员主要位于沭阳,而康德莱、维力医疗主要经营场所位于上海、广州等经济发达地区,公司研发人员的平均薪酬水平相对较低;(3)公司在研发设施建设投资方面与可比上市公司存在一定差距,研发设施折旧费用较少。
外销客户集中
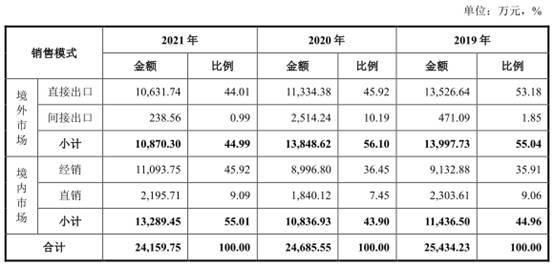
伟康医疗的销售市场主要分境外市场和境内市场,公司结合自身发展规模和产品特点,境外市场主要是以OEM方式生产销售,其中包括直接出口和间接出口;境内市场主要以经销为主、直销为辅。
公司境外市场主要以OEM方式生产销售,即根据境外客户的订单情况进行生产,产品贴客户的商标后进行销售。公司境外客户主要为境外大型医疗器械品牌运营商。
报告期内,公司境外直接出口金额分别为11,174.50万元、13,526.64万元、11,334.38万元和10,631.74万元,占主营业务收入的比重分别为47.58%、53.18%、45.92%和44.01%。
公司外销客户主要为Cardinal、Medline、Intersurgical和HUM,上述四家外销客户均为国外知名医疗器械品牌运营商,报告期内合计占公司直接出口收入的比重在70%以上。
三起违法违规受到行政处罚
伟康医疗在招股书中披露了报告期内三起违法违规受到处罚的情况,包括:一次性使用吸痰管真空控制装置不符合标准规定、一次性使用换药包环氧乙烷残留量不达标、一次性使用鼻胃管紫外吸光度不达标。
(一)一次性使用吸痰管真空控制装置不符合标准规定
2018年9月20日,国家食品药品监督管理总局发布“国家医疗器械监督抽检结果的通告(第7号)(2018年第90号)”,公告显示伟康医疗生产的一批次一次性使用吸痰管的真空控制装置不符合标准规定。2018年10月26日,江苏省药品监督管理局在其官网发布“国家医疗器械监督抽检结果的通告(第7号)(2018年第90号)江苏省处置情况”,对伟康医疗就上述一次性使用吸痰管的真空控制装置不符合标准规定的行为实施罚款20,000元的处罚,并要求采取修改模具,并进行验证的整改措施。2019年11月,沭阳县市场监督管理局就上述违规事项下达《行政处罚决定书》(沭市监案字〔2019〕10085号)。
(二)一次性使用换药包环氧乙烷残留量不达标
2021年2月25日,江苏省药品监督管理局向公司下达《行政处罚决定书》(苏药监宿械罚〔2020〕9号),因公司生产不符合经注册产品标准要求的一次性使用换药包(不合格项目是环氧乙烷残留量),给予35,000元罚款的行政处罚。前述不符合经注册产品标准要求的一次性使用换药包为2,000包,合计货值金额为6,000元。考虑到案发后公司积极配合调查,采取有效措施召回不合格产品818包并销毁,认真排查不合格原因,采取针对性措施整改,江苏省药品监督管理局给予中限处罚。
(三)一次性使用鼻胃管紫外吸光度不达标
2021年10月12日,江苏省药品监督管理局对伟康医疗出具《行政处罚决定书》(苏药监宿械罚[2021]7号),因公司于2021年3月5日生产的300支一次性使用鼻胃管的紫外吸光度不符合经注册产品标准要求(货值金额为7,425元),给予公司罚款45,000元的行政处罚。
产品因滞销、临近有效期、质量问题发生退换货
报告期内,公司销售给部分经销商的产品存在滞销或临近有效期的情形,根据协议约定或经双方协商一致,公司对相关产品进行退换货处理。
报告期各期退货金额分别为58.02万元、693.95万元、197.69万元和31.90万元。
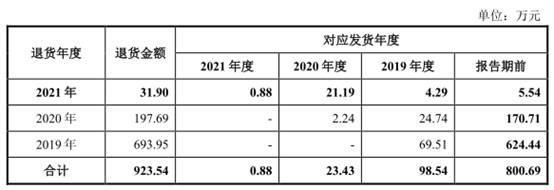
报告期内,公司因滞销、近效期的退货占以前年度对应发货金额比例总体较高,大多超过5%。
涉及经销商客户主要为部分国药系经销商、苏州多健医科仪器有限公司(以下简称“苏州多健”)和佛山市洁婧医疗器械有限公司及其关联企业(关联企业为佛山市易德康医疗器械有限公司,以下统一简称“佛山洁婧”)。
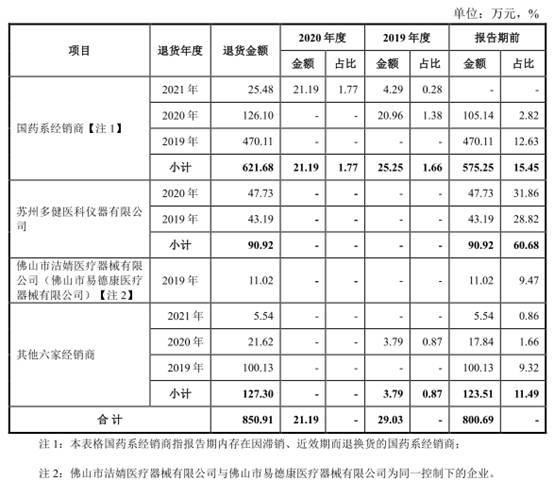
除上述因滞销、近效期的退换货外,报告期内,公司其他退换货的主要情形为产品因物流运输等原因造成外箱受潮或破损等包装问题、少数产品存在质量问题、部分客户下单型号有误等原因形成的退换货,退换货周期较短,大多在发货后一个月内发生。
此外,公司与河北国药、安徽国药、山东国药等5家国药系经销商签订的2020年度经销协议中约定,如其订货的品种或规格不适销,可以在公司发货三个月内申请调换货,调换货额度为年发货金额的2%。2020年、2021年相关退换货金额分别为14.43万元和8.61万元,合计占相关国药经销商2020年经销收入的比例为1.93%,相关退换货合计金额及占收入的比例均较小,不影响公司收入确认原则。根据公司与国药系经销商签订的2021年度经销协议,上述退换货条款已不再适用,公司原则上仅允许对非客户原因造成的产品缺损及质量问题进行退换货处理。
COPAC SYSTEMS ApS于2020年4月向公司采购密闭式吸痰管21.04万元。后因双方在产品质量标准等方面存在意见分歧,经协商一致,2021年1月COPAC SYSTEMS ApS将前述采购的密闭式吸痰管予以退回。报告期内,公司与COPAC SYSTEMS ApS不存在其他交易。公司按照资产负债表日后调整事项对2020年度该客户的收入及成本进行调整。