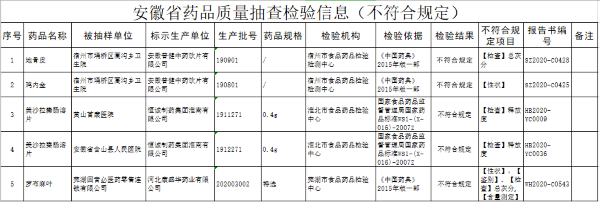
中国细胞治疗企业如何弯道超车?Lyell和Allogene研发方向值得借鉴
近年来,CAR-T疗法成为了癌症治疗领域的明星。CAR-T疗法全称是“嵌合抗原受体T细胞免疫疗法”(Chimeric Antigen ReceptorT-Cell Immunotherapy),它是利用人体本身免疫系统存在的T淋巴细胞,靶向消灭癌细胞的方法。
跟传统肿瘤疗法相比,细胞疗法首先是效率非常高,总的病情缓解率或者有效率高达70%左右,比常规的治疗高出很多;此外在相当一部分受试患者中,病人的总寿命或者总生存时间得到了很大的延长,相当于一部分病人能够达到治愈或者是接近治愈,这在所有肿瘤疗法中,已经是相当震撼的结果。
业界预测显示,CAR-T细胞疗法未来的市场空间预计在350亿美元至1000亿美元。国际上在CAR-T疗法领域领先的公司包括诺华、凯特制药(KitePharma)、Cellectis、Juno等。此外,辉瑞、新基(Celgene)等也积极介入这一领域。如2017年8月,美国生物制药巨头吉利德以119亿美元收购凯特。2018年1月,美国新基公司(Celgene)以90亿美元收购Juno公司90%的股权,之前该公司已拥有Juno近10%的股权。
传统认为,免疫细胞治疗领域的前三强为诺华、新基Juno、吉利德Kite。不过近两年来,美国新诞生的两家细胞治疗企业LyellImmunopharma公司、Allogene公司作为细胞治疗领域的后起之秀,大有与前三强并驾齐驱之势。
2017年,首款CAR-T产品获得美国FDA批准上市。迄今为止,全球范围内获批上市的也只有2款产品,包括用于B细胞前体急性淋巴性白血病治疗的Kymriah(曾用名CTL019,诺华制药产品)和用于非霍奇金淋巴瘤治疗的Yescarta(凯特制药产品KTE-C19)。截止2020年06月30日,全球获批上市的干细胞药品已有41个。相比较而言,免疫细胞治疗药物的获批速度进展缓慢。
不过,随着CAR-T疗法取得突破,细胞基因治疗产业在全球范围内进入快速大发展时期,预计至2030年,仅美国FDA就有望批准40至60种细胞和基因疗法。因此,在欧美国家,细胞疗法获批速度呈爆发趋势。而在我国,因2016年细胞治疗乱象,国内被叫停细胞治疗商业化临床实验,因而错过了CAR-T细胞疗法的快速发展期。
随后于2017年11月,国家药品审评中心受理我国首个CAR-T细胞产品IND的申请,使得我国细胞免疫治疗重新回到国家支持的创新赛道。随着科研投入的持续增加和技术实力的不断加强,我国开展的细胞与基因治疗临床研究正在逐年增加,每年新增数量仅次于美国。国内企业奋起直追,跑出了如传奇生物、永泰生物等快速成长的细胞免疫治疗企业。
未来是成为欧美细胞疗法的跟随者,还是在细胞治疗创新前沿能占有一席之地?值得观察。有观点认为,国内企业可能需要跨过传统CAR-T疗法的模仿式创新,直接步入CAR-T疗法的前沿创新领域,或许能实现在细胞治疗领域的弯道超车。
Lyell和Allogene各领风骚 国内企业或可借鉴
近日,在“高瓴HCare全球健康产业峰会”的“细胞治疗前沿及进展”分论坛上,药闻社主编张亮作为整个分论坛的专业内容总策划,对LyellImmunopharma公司联合创始人Rick Klausner博士、Allogene Therapeutics联合创始人DavidChang博士对细胞治疗最前沿动态的分享,做了全程的跟踪报道。
RICK KLAUSNER博士,是美国Lyelllmmunopharma公司创始人兼CEO,也是美国癌症研究所第11任主席,他现在也担任英国癌症研究中心、癌症大挑战项目主席,他是美国国家科学院、医学研究所以及美国艺术与科学院的院士。除此之外,RickKlausner博士还有一个身份,那就是细胞治疗三巨头之一,Juno Therapeutics公司的联合创始人,从事过接近30年过继性细胞疗法(adoptivecell therapy)研究。
Lyell的团队认为,虽然细胞治疗的研发已经取得了巨大进步,特别是在血液肿瘤方面,但是基于细胞的免疫疗法尚未在实体瘤中显示出实质性益处,而实体瘤代表绝大多数癌症,因此细胞疗法仍然存在很大的开发前景。Lyell的目标是开发针对任何癌症的基于治疗性细胞的免疫疗法,重点是嵌合抗原受体T细胞(CAR-T)和实体瘤。基于斯坦福大学和美国国家癌症中心的开创性工作,Lyell正在开发用于先前难治性肿瘤的下一代CAR-T细胞疗法。
David Chang博士,美国Allogene公司联合创始人、总裁、CEO,DavidChang博士之前曾担任Gilead子公司Kite的研发执行副总裁和首席医学官。他在肿瘤药物开发领域的创新方面拥有行业领先的业绩,包括开发Yescarta。
Allogene公司力图克服自体CAR-T疗法的缺陷,其采用的策略是开发同种异体的CAR-T疗法。与自体CAR-T疗法不同,同种异体的CAR-T疗法使用从健康供体中获得的T细胞。除了用基因工程在这些细胞中表达CARs以外,研究人员还通过基因编辑技术限制了患者免疫系统对这些非自身细胞的免疫反应,降低移植物抗宿主病(GVHD)发生的可能性。这些细胞可以被冷冻储藏起来,在患者需要时这些“现成”的疗法可以马上用于对患者的治疗。与自体CAR-T疗法相比,它能够缩短患者等待疗法的时间,提供更一致的T细胞原材料,而且根据Allogene公司的估算,一次生产流程可以产生用于治疗100名患者的CAR-T细胞,大大提高了CAR-T疗法的生产效率。
与传统三强不同,Lyell和Allogene两家公司的研发,是建立在新基Juno和吉利德Kite已有研发背景的基础上,其目标是力图改变现有CAR-T疗法的不足之处,并将该疗法运用于更大范围的实体瘤领域,且已经取得了阶段性成功。
细胞疗法,曾在国内也掀起过热潮。2016年的“魏则西事件”后,监管层紧急叫停细胞免疫治疗临床应用,并出台一系列政策规定加以重手整治,此前蓄势待发的细胞免疫治疗产业一夜入冬。2017年欧美跨药企率先获批CAR-T细胞疗法上市,中国的细胞疗法却在寒冬期缓慢发展。
国内企业对于CAR-T技术的研究主要还是沿着两个主线,一是沿着国外已经批准的适应症尽快在我国申报该适应症,并争取尽快拿到批准文件;二是紧跟国际研发潮流,努力做好CAR-T在实体瘤方面的研发,争取在相关领域或者适应症或者靶点上取得突破。基本上还属于细胞疗法传统三强的跟随者。
目前国内还未有一款独立研发的CAR-T疗法产品上市,在产品上市进度上已经慢于欧美药企至少三年时间,未来如果国内细胞治疗想要跻身于全球细胞治疗领先行列,关注Lyell和Allogene的研发方向,并在这一领域加大投入,或许能够有迈入全球CAR-T疗法最前沿领域的成功机会。
Lyell:下一代过继性T细胞疗法
RICKKLAUSNER认为,在过去的5年,即便知道可以根除一些肿瘤或者是一些病人的B细胞肿瘤,还是不知道怎么样能够100%消除这个肿瘤。即便是最先进的CD19靶点CAR-T疗法,事实上都有很大局限,也许只有50%的弥漫性、大B细胞淋巴瘤的病人能够被治愈,另外的50%就治不了。科学家们需要搞清楚治不了的原因。
现在大的挑战就是,治疗实体瘤的外援性的T细胞疗法,就是为了使得T细胞能够在实体瘤当中起到作用,关键的障碍是,对于T细胞,不管是用CAR还是TCR来入侵肿瘤的时候,具备很大的困难性。它们进入肿瘤之后,会被推动到特别的分化途径当中,这个过程叫做T细胞耗竭。
T细胞耗竭要么发生在已经侵入了肿瘤细胞,要么是发生在肿瘤细胞的边缘,但是T细胞耗竭现象只存在实体瘤当中,血液肿瘤领域并没有看到T细胞耗竭。
所以,T细胞耗竭成为治疗实体肿瘤一个最主要的障碍,就像实体肿瘤已经学会了用这一点关闭或者是消除T细胞的效能一样。可能有一些突变负荷比较高的肿瘤,可以考虑使用联合检查点疗法,即用免疫检查点抑制剂,使得一些已经失活的细胞重新被激活。
但目前为止,只有很小的一部分有实体瘤病人会对这个检查点抑制剂有反应,大多数的完全耗竭的T细胞是没有办法再被激活的,即便是用了联合检查点疗法也做不到,这就是目前的局限。
如何克服这个问题?T细胞耗竭是一个非常具体的细胞分化途径,它是受到一个非常具体的转录因素层级的驱动,在这个层级的顶层有一个叫做AP-1家族的转录因子。
Lyell研究人员发现,通过对AP-1转录因子进行遗传操控,也可以避免T细胞耗竭。他们已经在动物模型中证明此类T细胞能够消除肿瘤,希望在今后12-18个月之内通过遗传工程改造,将不会被耗竭的T细胞用于临床试验。
另一个难题就是生产制造能力。T细胞疗法,尤其是CAR-T细胞疗法,成本高,耗时长,操作困难。对此有三种应对对策,一是应用新技术来优化工艺和流程,降低生产成本;二是重新思考T细胞制备的细胞生物学,如之前提到的近乎神奇的T细胞子集,这样所需要的剂量就会非常少,可能一滴血就能提取所需要的T细胞了。
Allogene:同种异体CAR-T细胞疗法带来革命性转变
Allogene有多个临床管线资产,并计划将更多的项目推向临床阶段。Allogene目前已进入临床阶段的疗法分别是ALLO-501和ALLO-715。ALLO-501是一款靶向CD19的同种异体CART细胞疗法,用于治疗复发难治性非霍奇金淋巴瘤。ALLO-715用于治疗多发性骨髓瘤和其它表达B细胞成熟抗原的癌症,临床前实验展现出显著的作用。Allogene还有Allo316,(一种抗CD70AlloCAR-T治疗药物),CD70在多种血液系统恶性肿瘤甚至实体瘤(如肾细胞癌)中表达,因此Allogene计划探索ALLO-316在肾细胞癌中的临床疗效。
Allogene打造同种异体CAR-T细胞疗法平台
David之前曾经在Kite成功开发出自体CAR-T细胞疗法,通过对比,他认为通用型同种异体CAR-T细胞疗法,会使细胞疗法发生革命性的转变,因此Allogene的研发方向意味着在向传统的自体CAR-T细胞疗法划清界限。
David认为,同种异体CAR-T细胞疗法的可及性比较高,更容易重复对患者进行治疗,从单一健康共体提供的细胞,可以生成大量CAR-T细胞,满足大量患者的需求。也不需要过于复杂的物流环节和制备过程,其成本由于可量产而大幅降低,制备过程效率较高。
此外,从一名健康供体中获取细胞,可以制成治疗100名癌症患者的CAR-T药物,制备成本随之降低。从患者的角度来讲,速度以及可靠性至关重要,同种异体CAR-T细胞疗法是即用型的,又是由健康共体提供的细胞生成,因此可以高效的造福患者。
最后,自体CAR-T细胞疗法主要依靠逆转录病毒学和细胞信号转导,而同种异体疗法由于其制备过程的高效性,可以进行多种基因编辑和基因工程,这也非常有利于创新产品的优化。
Allogene现在正在全力打造同种异体CAR-T细胞疗法平台,这个平台的名字叫做AlloCAR-T,这个平台基于转录激活因子效应物核算酶技术,以及Allogene自有的淋巴清除技术,还有最先进的生产工艺,有了这个平台可以验证针现有靶点的疗效,并进一步发现针对血液肿瘤和实体瘤的更多靶点。
现在Allogene有4个临床项目以及16个临床前项目,适应症既包括了血液肿瘤,也包括了实体瘤。Allogene一直在开发变革性的技术,利用使用改进T细胞的健康程度,并致力于下一代同种异体CAR-T细胞疗法平台,主要基于免疫、逃逸机制。Allogene还继续关注实体瘤的靶点筛选,以及诱导多功能干细胞,这些创新技术是Allogene的前沿研究领域。
药闻社主编张亮认为,当前绝大多数中国细胞治疗企业还处在研究CD19靶点的CAR-T细胞疗法阶段,仍是诺华、新基Juno、吉利德Kite等细胞治疗巨头的拥趸。不过Juno和Kite两家企业的原创始人团队出走后,成立了LyellImmunopharma公司、Allogene公司,其研究方向是建立在此前成功开发出细胞治疗产品的基础上,这两家公司对产业未来的前瞻判断,或许对中国细胞治疗行业实现弯道超车更有现实意义。