医药生物行业投资报告:仿制药研发生产趋于标准化和规范化
【 事项】
9 月 4 日国家食品药品监督管理总局药品审评中心发布公告称, 为落实《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》( 2017 年第 100 号)的要求,评审中心按照总局领导指示组织起草了《中国上市药品目录集》(征求意见稿), 旨在收录具有完整规范的安全性和有效性研究数据获得批准的创新药和改良型新药,以及具有药学等效和生物等效的仿制药品,并确定参比制剂和标准制剂。鉴于《中国上市药品目录集》尚处于制定起步阶段,当前收录内容与品种还很少,后续将随着新品种的收录而逐步增加和扩充相应内容。
早在今年年初,国家药监总局副局长吴浈在 2017 年全国药品注册管理工作会议上就公开表示,建立我国的上市药品目录集迫在眉睫。要借鉴国际通行做法,结合中国国情,把新注册分类后批准上市的新药和仿制药及其参比制剂信息、通过仿制药质量和疗效一致性评价的品种及其参比制剂信息对外公开,引导和鼓励仿制药有序研发和申报注册。
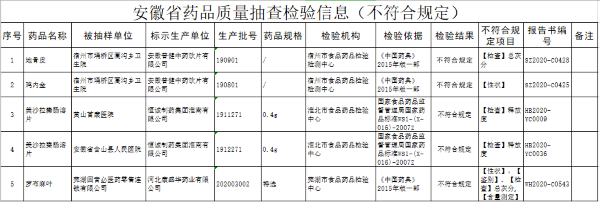
自从 2016 年 2 月国务院办公厅下达 《 关于开展仿制药质量和疗效一致性评价的意见》文件以来, 各个药企开始了漫漫一致性评价之路,不仅要花费大量的评价费用,还要纠结于无处寻找仿制药参比制剂和原研药厂家等相关信息。而此次中国药品橙皮书的出炉,无疑为仿制药药企解决了参比制剂选择的相关难题,为仿制药的研发生产提供了官方数据,使其趋于标准化和规范化。 目前包括美国和日本在内均出台了药品橙皮书,两国的橙皮书均对促进仿制药行业的发展有着积极的意义。虽然我国此次出台的药品橙皮书只是征集意见稿,暂时只包含了 19 种产品,其中进口原研药品 12 种,创新药 2 种,按化学药品新注册分类批准的仿制药 5 种, 但其对我国仿制药药企的研发生产具有非常重要的指导意义。
可以看到自上月底一致性评价政策正式出台之后本月初随即出炉了药品橙皮书, 因此我们认为一致性评价的开展为建立我国上市药品目录集(橙皮书)提供了契机,而橙皮书的出炉也为更好更快地推进一致性评价起到了指导性的作用。二者相辅相成, 促进整个仿制药行业的发展。
我们认为药品橙皮书对药企来说是把双刃剑,一方面提供了参比制剂选择及一致性评价开展思路, 另一方面来说也就限定了药品品种在进行一致性评价时的对照组大多数都为原研药,这就对药品本身的疗效有更高的要求。长久来看, 不仅有助于药企提高自身研发技术进行仿制药创新从而达到原研药药效水平,而且有助于仿制药行业的优胜劣汰。
同时,我们也认为随着上市药品目录集的不断完善,其与药企一致性评价的开展将更为衔接,有助于推动一致性评价的进程, 利好在标准化和规范化参比下一致性评价进展迅速的药企,凸显仿制药行业优质龙头价值。
相关报告:中国生物制药行业“十三五”发展趋势与投资机会研究报告