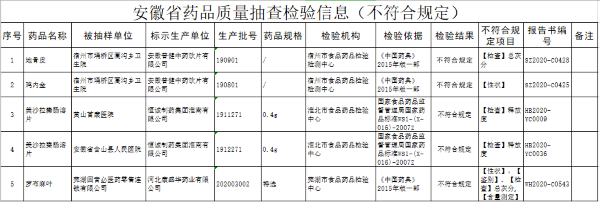
CFDA介绍2016上半年医疗器械的注册数据
医药网9月22日讯 9月20日-21日,由中国药品监督管理研究会主办的2016年首届中国药品监管科学大会在京召开。国家食品药品监督管理总局医疗器械注册司司长王者雄在会上介绍了2016上半年医疗器械的注册数据。
王者雄说,今年1-6月,总局共批准医疗器械注册4346项。其中首次注册1140项,延续注册2487项,许可事项更变注册719项。同时,总局共对298项医疗器械注册申请不予注册。
他表示,今年上半年的注册数量增幅明显,同比增长28.4%;其中国产体外诊断试剂增长势头迅猛。国产第三类IVD注册数量是国产有源+无源产品注册数量的2.5倍,注册数量排名前5的企业都是第三类IVD企业。
同时,国产医疗器械整体发展态势良好,国产第三类医疗器械注册数量多于进口注册数量。而且,国产医疗器械与进口医疗器械差异化趋势显现:进口产品主要为有源、无源,国产产品多在IVD,各有优势。
王者雄还表示,创新医疗器械审批成果已经显现,截止2016年6月底,共收到创新医疗器械特别审批申请379项,确定了63个产品进入创新医疗器械特别审批通道,已有16个创新医疗器械产品进入市场。如华大基因等公司的第二代基因测序仪、天津科宁公司的乳腺X射线数字化层摄影设备、北京品驰公司的植入式迷走神经刺激器、北京先瑞达公司的药物洗脱外周球囊扩张导管等。
王者雄介绍,目前《医疗器械优先审批程序》正在审核发布。
另据药监总局医疗器械技术审评中心主任孔繁圃在本届大会上发言,2016年1月至8月,共完成医疗器械技术审评7088项,共受理6765项。创新医疗器械进入特别审批通道,平均受理时间为37个工作日,比普通产品受理时间节省60%以上。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如有侵权行为,请第一时间联系我们修改或删除,多谢。