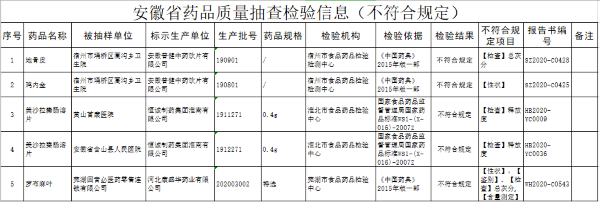
成熟细胞转化新疗法 再生医学迎来新势力
科学家曾认为,直到消亡,皮肤细胞依然是皮肤细胞。在过去10年,细胞的身份并不是一成不变的,它能够通过激活特异性的遗传程序得以重写。如今,再生医学领域面临一个问题:这种重写应当采取常规方法,即成熟细胞首先转化回干细胞,或者如果可能的话,采取一种更加直接的方法。
“终末分化”概述了这种旧观念——皮肤细胞、肌肉细胞等成熟细胞不能经过诱导获得一种显著不同的“命运”。10年前,这种观念开始摇摇欲坠,当时,日本京都大学细胞生物学家山中伸弥证实导入几个基因能够将成熟纤维原细胞(结缔组织细胞)转化为诱导性多能干细胞(iPS细胞)。类似于胚胎干细胞,iPS细胞能分化为任何一种类型的细胞,这一性质被称作为多能性。不同于胚胎干细胞的是,iPS细胞也能无限增殖。
仅仅在山中伸弥取得该发现几年后,研究人员就已开始发现改变细胞类型的捷径,他们称之为“直接重编程”。一种类型的成熟细胞经诱导后能直接变成另一种类型的成熟细胞,而不需要借助iPS细胞这一中间阶段。研究人员已了解到如何将皮肤细胞转化为神经元或心脏细胞,如何将胃细胞转化为分泌胰岛素的β细胞。德国美因兹古藤堡大学科学家Benedikt Berninger说:“就在你的眼前看到这些细胞改变身份是非常神奇的。”Berninger的研究利用直接重编程产生神经元。
相对于iPS细胞研究,直接重编程研究还处于更初始阶段,但是它正激发人们对再生医学的兴趣。直接重编程的细胞可能比通过iPS细胞中间阶段产生的细胞更加安全,因为后者可能具有与肿瘤细胞一样的广泛增殖能力,这会使得它们或许潜在地导致癌症产生。
基于iPS细胞的临床介入必需谨慎开展,以便确保没有多能性细胞与完全成熟的细胞一起移植。瑞典隆德大学神经生物学家Malin Parmar说:“风险就是你可能失去对这些细胞的控制,它们在移植后开始不受控制地增殖。但是,如果你绕过iPS细胞产生阶段,那么它将更加快速和更加安全。”Parmar希望利用直接重编程逆转帕金森病患者大脑中的神经元丢失。
改变遗传
重写细胞身份首先需要理解这些身份是如何建立的。每个细胞都能追踪其祖先到单个起源:受精卵。当胚胎细胞分裂和成熟时,它们的命运是由发育过程中特异性基因开启和关闭所确定的。被称作转录因子的蛋白首先结合到基因组中的某些DNA序列,随后激活或抑制附近的基因,从而调节这一过程。控制细胞命运的转录因子经常被称作“主调节因子”,这是因为它们控制着一连串复杂的基因活性。
美国哈佛干细胞研究所细胞生物学家Qiao Zhou说,“这些主调节因子基本上都是根据它们在胚胎发生时产生某些细胞类型中的关键性作用决定的。一个祖细胞可能变成细胞A、B或C,但是如果你迫使它表达某种主调节因子,它将最终变成细胞A。”
证实主调节因子能用于直接重编程的研究可追溯到1987年,当时来自弗雷德-哈金森癌症研究中心的Harold Weintraub、Andrew Lassar和同事证实诱导成纤维细胞表达某一DNA片段能够让它进入变成肌肉细胞的发育途径;他们随后发现导致这种变化的单个基因编码转录因子MyoD。加州大学旧金山分校格拉斯通心血管疾病研究所心脏发育研究员Deepak Srivastava说:“这在当时是一项颠覆性的发现。”
但事情并非这么简单。寻找单个能启动重编程的主调节因子遭遇滑铁卢,直到山中伸弥揭示出有效重编程的秘密并不是单个因子,而是多种基因的组合。随着研究人员混合和搭配不同的主调节因子组合,成功才开始出现。
2008年,哈佛大学科学家Douglas Melton团队将一种类型的胰腺细胞转化为β细胞,该细胞是很多糖尿病患者所需要的。作为团队一员,Zhou说,“结论是你仅需3种主调节因子实现这一点。”2010年,斯坦福大学干细胞科学家Marius Wernig团队也利用3种基因将成纤维细胞转化为神经元。
迄今为止,大多数开创性的直接重编程发现都是在体外培养的细胞中实现的。但如果能在体内促进细胞转化,很多研究人员就会对再生医学抱有更大希望。在一种器官中相对丰富的细胞群体或能转化为更迫切需要的其他类型的成熟细胞。迄今为止,研究人员已在动物实验中取得一些成就。比如,Parmar团队发现通过将携带编码重编程因子的基因的病毒载体注射进小鼠大脑中,能将神经胶质细胞转化为功能性神经元。Srivastava也类似地在心脏内将小鼠成纤维细胞转化为跳动的心肌细胞,这一策略可能提供一种治疗心脏病发作导致的心脏损伤的方法。但迄今为止,没有人在人体内尝试过直接重编程。
身份危机
到目前为止,大多数研究着重关注确保重编程过程成功。研究人员不仅需要找出启动这些基因的主调节因子组合,也不得不发现尽可能最小的组合。这是因为迫使一种细胞表达主调节基因的最可靠方法是运送这些基因的额外拷贝到这种细胞中,而相对于运送仅仅几种基因,运送很多种基因到细胞中更困难。找出最小的主调节基因组合需要一番艰苦跋涉:通常,潜在的组合名单比较巨大,唯一的筛选方法是系统性地逐一测试。比如,Parmar团队以12种候选基因开展产生多巴胺的神经元的研究,经过一番筛选后,最终缩小到两种基因。
一些研究人员已开始设计专门用于直接重编程的软件。一个横跨三大洲的团队已开发出一种被称作Mogrify的实验规划工具,这个工具将来自众多细胞类型的大量基因表达数据与不同主调节因子控制的基因网络方面的规则汇集在一起。基于这些数据和规则,Mogrify可预测导致所需细胞身份变化的重编程因子组合。
但提供有活性的主调节基因并不足以确保完全的重编程:这些主调节基因可能成功地将细胞设置在一个发育途径上,但会让它处于一种未成熟的前体细胞状态。因此接下来的任务就是鉴定出哪些基因必须处于活性状态完成这一发育过程。
然而,真正重要的细胞身份测试是重编程细胞是否在功能上能够替换自然分化的细胞。美国得州大学西南医学中心神经生物学家Chun-Li Zhang说:“如果它们看起来像是神经元,而且它们的基因表达也类似于神经元,这并不意味着它们是真正的神经元。”令人信服的证据需要接受一系列评估,比如利用电生理学测量证实一种新形成的神经元是否放电,因而是否能够激活与它通过突触连接在一起的其他神经元。Zhou表示,没有一种特征性的评估方法能够独自提供具有足够说服力的证据。
通往临床之路
这些方法在人体测试之前还有很多障碍要克服。一般而言,已证实相比于小鼠细胞,人细胞在进行直接重编程时更加充满挑战:它们倾向于花费更长时间经历这个重编程过程,虽然一些转录因子足以在动物实验中实现直接重编程,但是人细胞经常需要额外的转录因子。基因转运也带来巨大挑战,特别是将基因转运进大脑等器官中。
另外,还会存在拆了东墙补西墙的问题。在大脑中,将神经胶质细胞转化为神经元会降低那里的神经胶质细胞数量,而这本身就可能产生风险。
心脏治疗很可能最接近于临床应用。Srivastava团队已开始研究将猪心脏内的成纤维细胞转化为心肌细胞。他说:“我们有初步的概念验证:即便在像我们这样大的心脏中也能够实现转化的效果。”如今,这个团队正在开展安全性研究,并优化基因运送方法。
Zhou团队努力将体外培养的人胃肠道细胞直接转化为β细胞,并且也正在努力在诊所中开展应用。这些肠道细胞很容易通过活组织检查获得,而且在体外培养和重编程后,在理论上,它们能够移植到患有糖尿病的志愿者的胰腺中。
无论如何,直接重编程正开始获得产业界的关注,不过生物技术公司和制药公司并没有准备好投入其中。Zhou说,“迄今为止,还没有同等数量的资源和人力投入到这种方法中。但是这个领域正在快速赶上,我迫不及待地想看到它将会如何发展。”