贝奥生物质量管理体系存在“严重缺陷” 被要求停产
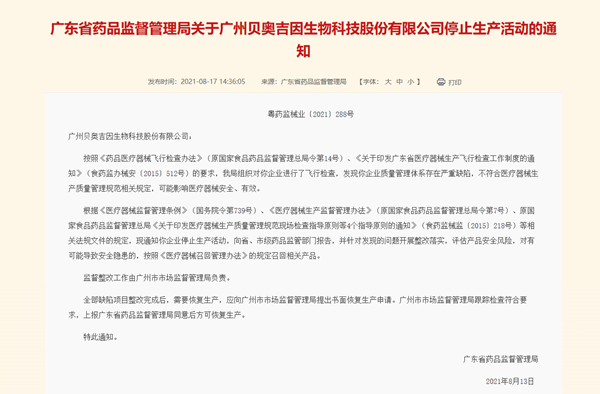
中国网财经8月19日讯 近日,广东省药监局发布关于广州贝奥吉因生物科技股份有限公司停止生产活动的通知。
通告显示,按照《药品医疗器械飞行检查办法》(原国家食品药品监督管理总局令第14号)、《关于印发广东省医疗器械生产飞行检查工作制度的通知》(食药监办械安〔2015〕512号)的要求,广东省药监局组织对广州贝奥吉因生物科技股份有限公司进行了飞行检查,发现企业质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定,可能影响医疗器械安全、有效。
广东药监局表示,现通知企业停止生产活动,向省、市级药品监管部门报告,并针对发现的问题开展整改落实,评估产品安全风险,对有可能导致安全隐患的,按照《医疗器械召回管理办法》的规定召回相关产品。
资料显示,广州贝奥吉因生物科技股份有限公司成立于2011年9月,从事生物医用材料研发,生物医用材料技术服务、生物技术服务等。郭瑞为法定代表人、董事长兼总经理。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如有侵权行为,请第一时间联系我们修改或删除,多谢。