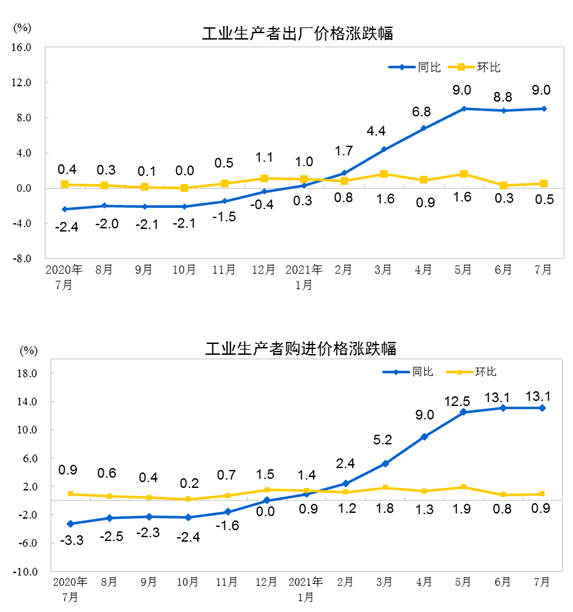
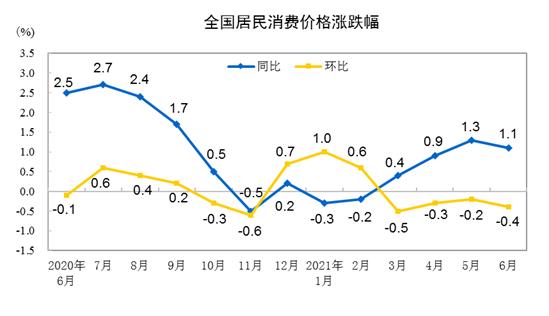
仿制药一致性评价首批17个目录公布 原研药被迫大幅降价
仿制药质量和疗效一致性评价工作取得阶段性成果。国家食品药品监督管理总局日前发布了首批17个通过仿制药质量和疗效一致性评价药品的目录。
这也意味着,在中国人用上高质量药品的同时,高价的原研进口药也将面临挑战。
原研药“被迫”降价
仿制药质量和疗效一致性评价是对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,开展一致性评价研究,最终使仿制药在质量和疗效上与原研药一致,在临床上实现与原研药互相替代的一项工作。
随着一致性评价工作的推进,越来越多的仿制药会触动原研药的价格。
国家食药监总局药品审评中心负责人表示,仿制药在保障百姓健康和推动中国医疗卫生事业发展中有着不可替代的作用,但我国仿制药部分品种在质量和疗效上跟原研药还存在一定差异。
该负责人也表示,通过一致性评价工作,实现仿制药和原研药互相替代,可进一步提高仿制药质量,保障百姓用药安全、有效、可及,还能够大大降低百姓的用药负担,减少医保支出,提高医保基金的使用效率。
事实上,这种成效正在显现。
上述负责人介绍称,“以(肺癌靶向药)吉非替尼为例,原来都是500元一片,5000元一盒,一个月要花1.5万元。而我国齐鲁制药的吉非替尼获批后,跨国公司的吉非替尼价格急剧下降,据说目前价格不到3000一盒,而齐鲁制药的只有1660元。这样大幅度推动市场竞争,能取得更加合理的价格,使更多的患者受益。”
一致性评价进展
2015年8月,国务院印发《关于改革药品医疗器械审评审批制度的意见》,将“提高仿制药质量,加快仿制药质量一致性评价,力争2018年底前完成国家基本药物口服制剂与参比制剂质量一致性评价”作为改革药品审评审批制度的五大目标之一。
2016年2月,国务院发布《关于开展仿制药质量和疗效一致性评价的意见》,标志着一致性评价工作全面开启。该意见再次明确了评价对象和时限,要求化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。
2017年10月1日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,对持有人提出了相关要求,即通过一致性评价的药品品种的生产企业(持有人),须确保生产工艺与批准工艺一致且生产过程持续合规,确保销售的各批次药品与申报样品质量一致,确保对上市药品进行持续研究,及时报告发生的不良反应,评估风险情况,并提出改进措施。
对于289个仿制药在2018年底是否能完成一致性评价的问题,上述负责人认为,不能牺牲质量来换取速度。
他表示,首要是明确参比制剂。289个基药品种共467个品规, 其中,171个品种231个品规已明确参比制剂;109个三改品种共计140个品规的参比制剂也基本明确;3个OTC专论活性成分品种共计6个品规无需推荐参比制剂;12个国产特有品种的一致性评价方案正在积极研究中,如涉及临床有效性试验或存在特殊情形的,可在2021年底前完成一致性评价。此外,289个品种中有57个品种可豁免或简化体内BE。企业可根据品种情况,进行一致性评价研究。
对于有明确临床价值的且无企业备案或企业明确放弃的品种,食药监总局将及时公布相关名单,推动一致性评价工作,保证药品的可及性。